Investigación
Montaje y puesta a punto de un equipo para plastinación de órganos destinados a la enseñanza
Assembly and fine-tuning of equipment for plastination of organs intended for teaching
Montagem e colocação em funcionamento de um equipamento para plastinação de órgãos destinados ao ensino
Montaje y puesta a punto de un equipo para plastinación de órganos destinados a la enseñanza
Ciencia, Docencia y Tecnología, vol. 33, núm. 66, 2022
Universidad Nacional de Entre Ríos
Recepción: 11 Marzo 2022
Aprobación: 12 Agosto 2022
Resumen: La técnica de plastinación de piezas anatómicas es un método eficaz para la conservación de materiales naturales. Los objetivos de este trabajo fueron lograr el montaje y puesta a punto de un equipo para plastinación a temperatura ambiente, con instrumentos y materiales accesibles, y optimizar las técnicas de procesamiento para obtener piezas anatómicas conservadas de calidad destinadas a la enseñanza. Se trabajó con cortes de encéfalos vacunos de 1 cm de espesor, fijados con formol al 5 % a 5 °C por períodos no menores a 10 días, posterior deshidratación en acetona a −25 °C, impregnación forzada con resina poliéster en un proceso lento, a temperatura ambiente, alternando períodos activos y pasivos, y posterior curado con exposición al uv. Las piezas obtenidas permitieron diferenciar claramente las estructuras internas del encéfalo, así como las sustancias gris y blanca. Se observó disminución en el peso y grosor de las muestras y oscurecimiento después de la realización de la técnica, pero se conservaron los detalles anatómicos, haciéndolas aptas para la enseñanza de la anatomía macroscópica.
Palabras clave: plastinación, resina poliéster, plastinación de cortes de encéfalo, conservación.
Abstract: The technique of plastination of anatomical pieces is an effective method for the conservation of natural materials. The objectives of this work were to achieve the assembly and fine-tuning of equipment for plastination at room temperature, with accessible instruments and materials, and to optimize the processing techniques to obtain quality preserved anatomical pieces intended for teaching. We worked with 1 cm thick bovine brain sections, fixed with 5 % formaldehyde at 5 °C for periods of no less than 10 days, subsequent dehydration in acetone at −25 °C, forced impregnation with polyester resin in a slow process, at room temperature, alternating active and passive periods and subsequent curing with exposure to uv. The pieces obtained made it possible to clearly differentiate the internal structures of the brain, as well as the grey and white substances. A decrease in the weight and thickness of the samples and darkening were observed after the performance of the technique, but the anatomical details were preserved, making them suitable for teaching macroscopic anatomy.
Keywords: plastination, epoxy resin, plastination of brain sections, preservation.
Resumo: A técnica de plastinação de peças anatômicas é um método eficaz para a conservação de materiais naturais. Os objetivos deste trabalho foram realizar a montagem e colocação em funcionamento de um equipamento para plastinação a temperatura ambiente, com instrumentos e materiais acessíveis e otimizar as técnicas de processamento para obter peças anatômicas conservadas de qualidade destinadas ao ensino. Trabalhamos com cortes de cérebros bovinos de 1 cm de espessura, fixados com formol a 5% a 5 °C por períodos não inferiores a 10 dias, posterior desidratação com acetona a −25 °C, impregnação forçada com resina poliéster em um processo lento, em temperatura ambiente, alternado períodos ativos e passivos e posterior cura com exposição a uv. As peças obtidas permitiram diferenciar claramente as estruturas internas do encéfalo, bem como as substâncias cinzenta e branca. Após a realização da técnica, observou-se diminuição do peso e espessura, e escurecimento das amostras, mas os detalhes anatômicos foram conservados tornando-as adequadas para o ensino de anatomia macroscópica.
Palavras-chave: plastinação, resina poliéster, plastinação de cortes de encéfalo, conservação.
Introducción
En la enseñanza de la anatomía, el uso de preparaciones de especímenes biológicos sigue siendo el método más eficiente para lograr que el estudiante comprenda el tema en estudio. Las técnicas de fijación y conservación anatómica siguen siendo, por lo general, soluciones que contienen formol debido su bajo costo. Sin embargo, presentan varias desventajas, como el olor irritante, la rigidez, los cambios de coloración de las estructuras, así como la toxicidad con potencial cancerígeno, teratogénico y mutagénico para quien lo manipula. La Agencia de Protección Ambiental (Environmental Protection Agency, epa) de Estados Unidos catalogó al formaldehído como probable carcinógeno en seres humanos en situaciones de exposición extraordinariamente alta y/o prolongada (epa, 1989). El Instituto Nacional del Cáncer (nci) de los Estados Unidos ha realizado estudios epidemiológicos sobre la exposición ocupacional al formaldehído y el aumento del riesgo de cáncer. Algunos de estos estudios mostraron un aumento en el riesgo de padecer algunas formas de cáncer con la exposición al formaldehído (nci, 2006). La Organización Mundial de la Salud (oms) lo ha incluido entre las sustancias cancerígenas (oms, 2005).
Por lo antes expuesto, es deseable utilizar otros métodos para la conservación. En la cátedra de (información suprimida en resguardo del anonimato), se ha implementado un equipo para plastinación basado en el método desarrollado por Gunther von Hagens en 1979. En este proceso, el agua y los lípidos en los tejidos biológicos y la sustancia utilizada como fijador son reemplazados por polímeros plásticos, como por ejemplo siliconas, resinas epóxicas o poliéster, los cuales son posteriormente endurecidos, resultando especímenes secos, sin olor y durables. Con el paso del tiempo se han ido introduciendo distintas modificaciones a la técnica original con los objetivos de simplificar el proceso, lograr mayor contraste entre las estructuras, disminuir los costos y adaptarlas a las necesidades particulares de cada centro de investigación o estudio, sin desmerecer la calidad (Ottone, 2018). Pueden mencionarse trabajos como el de Bravo, donde se ensayó la impregnación tanto con silicona como con resinas epoxi y poliéster y deshidratación con acetona y alcohol etílico (Bravo, 2006). El trabajo de conservación de cortes delgados de cerebro fue publicado por Henry y Latorre, con muy buenos resultados para la deshidratación con acetona a −25 °C y posterior impregnación en resina poliéster (Henry y Latorre, 2007). Los autores han investigado también la polimerización con incidencia de luz uv y refrigeración para impedir el daño tisular por la exotermia de la reacción de polimerización (Latorre y Henry, 2007; Ottone, 2018). Uno de los problemas que pueden presentarse es la retracción de los tejidos, cuestión que puede minimizarse utilizando para la deshidratación acetona a −25 °C, como indica la técnica utilizada en la Universidad de Murcia, que mostró los mejores resultados en un estudio comparativo con otros protocolos (Valdez, 2010). Otros trabajos muestran los resultados obtenidos con la utilización o no de catalizador de polimerización durante la impregnación forzada, para permitir su reutilización (Valenzuela et al., 2012). En la unc, obtuvieron piezas anatómicas destinadas a la enseñanza con elasticidad, flexibilidad y conservación de la coloración, utilizando una técnica de impregnación con silicona (Sánchez Carpio et al., 2012). Un avance muy importante es lograr la impregnación forzada a temperatura ambiente (Henry, 2007; Ottone et al., 2016; Ottone et al., 2018), ya que entonces no se requiere de un freezer de grandes dimensiones y elevado costo para esta etapa. Los objetivos del trabajo fueron lograr el montaje y puesta a punto del equipo para plastinación de cortes de encéfalo a temperatura ambiente, con instrumentos y materiales accesibles, y optimizar las técnicas de procesamiento para obtener piezas anatómicas conservadas de calidad destinadas a la enseñanza.
Materiales y método
Para obtener material natural conservado de alta calidad se seguirá una metodología experimental, basada en la revisión bibliográfica y el montaje del equipo con instrumentos y materiales accesibles en nuestro medio, y la adaptación y optimización de las técnicas que ofrezcan los mejores resultados de acuerdo con los recursos disponibles y los requerimientos para la enseñanza de la asignatura. Para apreciar la calidad de los materiales obtenidos, se evaluarán su textura, consistencia, coloración, tamaño y durabilidad.
El equipo consta de dos partes fundamentales: un sistema de vacío, donde se produce la impregnación forzada, y un sistema eléctrico, de alimentación y control.
Sistema de vacío
Consta de una cámara de impregnación, un vacuostato y una bomba de vacío (Fig. 1). La cámara de impregnación consiste en un recipiente cilíndrico de acero inoxidable, con dos conexiones, una para el sensor del vacuostato y otro para la conexión con la bomba. El borde superior cuenta con o’ring que amplía la superficie de apoyo de la tapa de cristal de 10 mm, creando un cierre hermético y asegurando el vacío dentro de la cámara. Los equipos están interconectados por medio de mangueras malladas aptas para soportar alto vacío, reforzadas con abrazaderas en los acoples.
La conexión entre la cámara de impregnación y el vacuostato presenta un manómetro que permite medir la presión interna de la cámara durante el ciclo de trabajo. Entre el manómetro y la cámara de impregnación se colocaron dos válvulas esféricas, una con el fin de aislar la cámara y otra para romper el vacío cuando sea necesario. Entre la conexión cámara-bomba se encuentra otra válvula esférica que permite aislar la cámara de impregnación de la bomba. Para disminuir pérdidas eventuales de vacío todas las uniones fueron selladas con teflón. La bomba de vacío, de ½ HP de potencia, presenta dos conexiones, una para la cámara de impregnación y otra, la salida del filtro que lleva los vapores resultantes del proceso. Sobre este último se realizó una conexión con el exterior para permitir la eliminación de los vapores de la cámara de impregnación al momento de trabajo. El vacuostato utilizado para el control de la presión de vacío trabaja en el rango: 1 a 0 bar.

Sistema eléctrico
Como muestra la Figura 2, fue montado sobre un tablero confeccionado por el equipo de trabajo. Consta de los siguientes instrumentos: llave termomagnética bipolar (1), tiene como función proteger el circuito ante eventuales sobrecargas y cortocircuitos, además de poseer un control independiente a la presión de vacío. El vacuostato (2), elemento de control que posee una parte eléctrica y otra de sensado. La parte eléctrica se conecta con el circuito de alimentación y con un contactor (3). Con ayuda del visor que posee en el frente, se selecciona el valor de presión de vacío deseado. Una vez alcanzado dicho valor, el vacuostato acciona el contactor que abre el circuito de alimentación de la bomba de vacío. Tomacorrientes (4), donde se conecta la bomba de vacío.

Se confeccionaron protocolos teniendo en cuenta la bibliografía y materiales accesibles. Se elaboraron planillas de registro para cada una de las cuatro etapas de cada protocolo. Se registró peso y dimensiones de las muestras antes de cada etapa y final, con el objeto de poder determinar cuál ofreció el menor porcentaje de retracción (Valdés, Vega y Valenzuela, 2010).
Descripción del proceso: Se plastinaron cortes de encéfalos vacunos provenientes de frigoríficos habilitados por senasa.
Corte y fijación: Se realizaron cortes coronales sucesivos de 1 cm de espesor. Previamente al acondicionamiento del material, dada la friabilidad del tejido nervioso, fue necesario enfriar los encéfalos a 5 °C en baño de agua (Sora, 2016) para evitar roturas al hacer la limpieza del material y los cortes. Como ha sido señalado desde las primeras publicaciones sobre la técnica por von Hagens en 1977 hasta la actualidad, es muy importante controlar el tiempo, la concentración de formol y la temperatura durante la fijación para evitar el oscurecimiento de las muestras (Jiménez Mejía e Isaza Castro, 2005; Bravo, 2006; Sora, 2016). Luego, los cerebros fueron lavados en agua corriente durante una semana para eliminar el exceso de formol en los tejidos (Guerrero et al., 2019).
Etapa de deshidratación: Se recomienda la utilización de acetona en concentraciones crecientes, comenzando por soluciones de concentración no mayor al 70 % para finalizar con acetona al 100%, tanto a temperatura ambiente como a −20 °C y −25 °C por períodos de entre dos días y hasta cinco semanas. El volumen de solución deshidratante recomendado es 10 veces mayor que el de la muestra, para permitir su rápida penetración y disminuir así la retracción (von Hagens, Tiedemann y Kriz, 1987; Bravo, 2006; Henry y Latorre, 2007; Sánchez Carpio et al., 2012; Valenzuela et al., 2012; Ottone et al., 2014).
La impregnación forzada: Es una etapa clave del proceso, basada en reemplazar la acetona (solvente de alta presión de vapor y bajo punto de ebullición) por un polímero (baja presión de vapor y alto punto de ebullición) a través de la aplicación de vacío, por el tiempo necesario. El solvente extraído del preparado se desprende en forma de burbujas cuya velocidad de desprendimiento es necesario regular a medida que se disminuye la presión en la cámara (Sánchez Carpio et al., 2012). Es importante que el desprendimiento de las burbujas, indicador de la velocidad a la que penetra la resina, sea moderada, ya que a altas velocidades aumenta la posibilidad de retracción de las muestras (Fonseca-Matheus, 2018). Realizar el proceso en forma lenta disminuye el grado de retracción del tejido al permitir que el polímero ingrese mejor en él, desplazando el solvente (Ottone et al., 2014). Al trabajar con encéfalos, se optó por utilizar resina poliéster ya que brinda excelente diferenciación de sustancias gris y blanca. Previo a la impregnación forzada con la resina poliéster preacelerada (genérica), la muestra fue sumergida totalmente en la misma, y para evitar que flote, se colocó por encima una pequeña rejilla de acero inoxidable durante veinticuatro horas antes de comenzar a aplicar vacío. Se han desarrollado técnicas de impregnación forzada con resina poliéster tanto a baja temperatura como a temperatura ambiente y con aplicación de vacío por períodos variables. Para la impregnación con resina poliéster es necesario preservar el sistema de la luz, ya que esta actúa como catalizador (Bravo, 2006; Latorre y Henry, 2007; Valenzuela et al., 2012).
Etapa de curado, endurecimiento o polimerización: Distintos autores coinciden en recomendar que se elimine de la superficie de las muestras el exceso de resina previo a someter el espécimen a la acción del catalizador en distintas concentraciones. También puede variarse la temperatura y la exposición al uv, de acuerdo con el tiempo que se quiera invertir en el proceso y las características finales deseadas (Bravo, 2006; Henry y Latorre, 2007; Valenzuela et al., 2012; Ottone, 2018).
A partir de estas publicaciones, se diseñaron los siguientes protocolos a ensayar:
Para la fijación se utilizaron concentraciones de formol al 5 y 10 %, en cada caso por períodos de cinco y diez días, a temperatura ambiente y a 5 °C.
Para la deshidratación con acetona, se ensayó con concentraciones crecientes a partir de 70 % hasta acetona pura, por períodos entre dos y hasta diez días, tanto a temperatura ambiente como a −20 y −25 °C.
Para la impregnación forzada se ensayaron períodos de duración total de 24, 48 y 72 horas. Se disminuyó la presión desde 760 mmHg hasta 5 mmHg, alternando períodos de impregnación activa y pasiva.
El curado se realizó a temperatura ambiente, por un tiempo de siete días, previa aplicación del catalizador por aspersión sobre la superficie, con y sin exposición a la luz uv.
Resultados y discusión
Para la fijación con formol, los mejores resultados se obtuvieron con concentración de 5 % a 5 °C. No se observó oscurecimiento ni variaciones importantes en las dimensiones de las muestras, por lo que se utilizaron las de estas condiciones para continuar con el proceso. En la Tabla 1 se muestran pruebas realizadas con diferentes concentraciones de formaldehído:
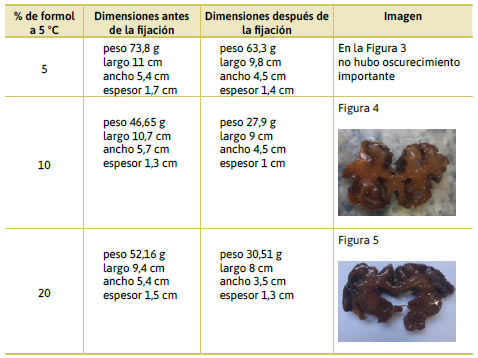
En la etapa de deshidratación, los mejores resultados se obtuvieron utilizando un protocolo similar a los publicados por Bravo y Latorre y Henry trabajando a −25 °C, utilizando acetona al 70, 90 y 100 % durante un tiempo de dos días (Bravo, 2006; Latorre y Henry, 2007). Además, trabajar con acetona a −25 °C asegura estar por debajo de su punto de inflamabilidad. No fueron satisfactorios los resultados obtenidos con deshidratación a temperatura ambiente, donde la retracción del tejido fue notable y las piezas perdieron el 40 % de su volumen en promedio. Este resultado es coincidente con lo publicado por otros autores en cuanto a la retracción del tejido en la deshidratación a temperatura ambiente, eliminando la influencia de otros factores (Rivera et al., 2009; Cano Álvarez y Londoño Sánchez, 2008; Ottone et al., 2021). También observamos una retracción importante cuando la inmersión en acetona en concentraciones crecientes se prolongó más de cinco días ya que la retracción del tejido superó el 30 % en promedio en esta etapa.
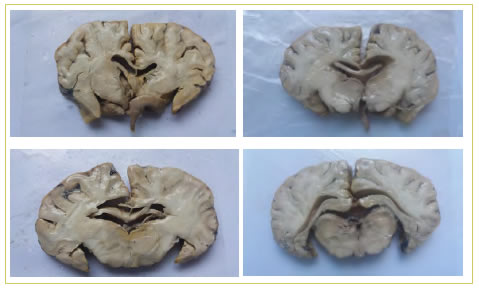
En la impregnación forzada con resina poliéster a temperatura ambiente, los mejores resultados se obtuvieron con una disminución lenta de la presión, con ∆= 100 mmHg durante el tiempo necesario para que cese el burbujeo del solvente (acetona) antes de aumentar la presión de vacío. Cuando la presión alcanzó los 100 mmHg, se disminuyó el ∆= 50 mmHg, luego se disminuyó el ∆= 10 mmHg y finalmente a 5 mmHg. Esta etapa insumió en total tres días con períodos de nueve horas de aplicación de vacío en forma activa, separados por períodos de impregnación pasiva (con apagado de la bomba y cierre del circuito para mantener en lo posible la presión de vacío durante la noche). En concordancia con otros autores, el protocolo aplicado de impregnación lenta ofreció los mejores resultados en tanto no se presentaron retracción importante ni deformaciones (Bravo 2006; Jiménez Mejía e Isaza Castro, 2005; Ottone et al., 2014). La alternancia de períodos de impregnación activa y pasiva, al igual que han publicado otros autores (Prieto et al., 2019), favoreció una menor retracción del tejido. Finalizada la impregnación forzada, se apagó el circuito eléctrico y se esperó que la presión dentro del sistema igualara la atmosférica para abrir la cámara de impregnación. La muestra se dejó escurrir para eliminar el exceso de resina de su superficie. La Figura 3 ofrece fotografías de las muestras en esta etapa, previo a su posicionamiento final para el curado. Realizar el proceso de impregnación usando la resina solamente, sin catalizador, permite su reutilización disminuyendo los costos. Este procedimiento también ha sido realizado por otros autores (Guerrero et al., 2019) con éxito.
Los mejores resultados de la etapa de curado se obtuvieron a temperatura ambiente, repitiendo la aplicación de catalizador a diario por tres días consecutivos, con exposición al uv y manteniendo los contenedores cerrados hasta lograr el endurecimiento de la superficie. A partir de allí, se quitó la lámpara UV para que continuara paulatinamente la polimerización al interior de la pieza. Por el contrario, en el proceso con menor aplicación de catalizador y sin exposición al uv, la retracción en el tejido fue mayor. Otros autores (Guerrero et al., 2019) evitan el uso de catalizador por el riesgo de eventual reacción de este con la peroxidasa del tejido, si la fijación no ha sido perfecta. En nuestra experiencia, no hubo inconveniente con el uso del catalizador.
En la experiencia realizada, las etapas de deshidratación en acetona y curado fueron las más críticas para evitar la retracción del tejido, así como el oscurecimiento de las muestras respecto al color original ocurre fundamentalmente durante la fijación y el curado.
Conclusión
Las piezas obtenidas de la plastinación de cortes de encéfalo con resina poliéster a temperatura ambiente permitieron diferenciar claramente las estructuras internas del encéfalo, así como las sustancias gris y blanca. Se observó disminución en el peso y grosor de las muestras y oscurecimiento después de la realización de dicha técnica, pero se conservaron los detalles anatómicos, haciéndolas aptas para la enseñanza de la anatomía macroscópica.
Referencias bibliográficas
Bravo, H. (2006). Plastinación, una herramienta adicional para la enseñanza de la anatomía. International Journal of Morphology, 24(3), 475-480. https://dx.doi.org/10.4067/S0717-95022006000400029
EPA. U.S. Environmental Protection Agency, Office of Air and Radiation (1989). Report to Congress on Indoor Air Quality, volumen II: Assessment and Control of Indoor Air Pollution.
Fonseca-Matheus, J. (2018). La técnica de plastinación, sus fundamentos y alternativas de menor costo. Gaceta de Ciencias Veterinarias, 22(2), 43-47. https://revistas.uclave.org/index.php/gcv/article/view/321
Guerrero, M.; Vargas, C.; Alarcón, E.; Del Sol, M. y Ottone, N. (2019). Desarrollo de un protocolo de plastinación de cortes con resina poliéster aplicado a secciones de cerebro humano. International Journal of Morphology, 37(4), 1557-1563. https://dx.doi.org/10.4067/S0717-95022019000401557
Henry, R.W. (2007). Silicone Plastination of Biological Tissue: Room-temperature Technique North Carolina Technique and Products. J. Int. Soc. Plast., 22, 26-30.
Henry, R.W. y Latorre, R. (2007). Polyester Plastination of Biological Tissue: P40 Technique for Brain Slices. Journal of the International Society for Plastination, 22, 59-68.
International Agency for Research on Cancer (2006). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, volumen 88: Formaldehyde, 2-Butoxyethanol and 1-tert-Butoxypropan-2-ol. http://monographs.iarc.fr/ENG/Monographs/vol88/index.php
Jiménez Mejía, R. e Isaza Castro, O. (2005). Plastination: a modern anatomical technique. Iatreia, 18 (1), 99-106.
Latorre, R. y Henry, R.W. (2007). Polyester Plastination of Biological Tissue: P40 Technique for Body Slices. J. Int. Soc. Plastination, 22, 69-77.
Ottone, N.E.; Cirigliano, V.; Lewicki, M.; Bianchi, H.; Aja-Guardiola, S.; Algieri, R.; Cantin, M. y Fuentes, R. (2014). Plastination Technique in Laboratory Rats: an Alternative Resource for Teaching, Surgical Training and Research Development. International Journal of Morphology, 32(4), 1430-1435. https://dx.doi.org/10.4067/S0717-95022014000400048
Ottone, N.; Del Sol, M. y Fuentes, R. (2016). Report on a sheet plastination technique using commercial epoxy resin. Int. J. Morphol., 34(3), 1039-1043.
Ottone, N. (2018). Plastinación: Fundamentos de las técnicas y su implementación en la Universidad de La Frontera. J. Health Med. Sci, 4(4), 293-302.
Ottone, N.E.; Guerrero, M.; Alarcón, E. y Navarro, P. (2021). Análisis estadístico de los niveles de retracción de cortes de cerebro humano conservados mediante la técnica de plastinación de cortes con resina poliéster. Int. J. Morphol, 1(2), 2.
Organización Mundial de la Salud (2005). Manual de bioseguridad en el laboratorio.
Prieto, R.; Vargas, C.; Veuthey, C.; Aja-Guardiola, S. y Ottone, N. (2019). Conceptos fundamentales del protocolo modificado de plastinación a temperatura ambiente con silicona, con posterior pigmentación, y su aplicación para la conservación de placenta humana. International Journal of Morphology, 37(1), 369-374. https://dx.doi.org/10.4067/S0717-95022019000100369
Sánchez Carpio, C.; Andromaco, M.; Páez, R.; Barello, M. y Pedernera, G. (2012). Estudio de nuevas técnicas para conservación de piezas anatómicas, plastinación. Revista de Salud Pública, (xvi) 3, 27-32.
Sora, M. (2016). The general protocol for the s10 technique. Research and Clinical Medicine, 1(1), 14-18.
Valdés, F.; Vega, E. y Valenzuela, M. (2010). Estudio comparativo de dos técnicas de plastinación. International Journal of Morphology, 28(3), 783-786. https://dx.doi.org/10.4067/S0717-95022010000300020
Valenzuela, M.; Azocar C.; Werner, K.; Vega, E. y Valdés, F. (2012). Experiencia en plastinación con resina poliéster P-4 para cortes anatómicos. Int. J. Morphol, 30(3), 810-813.
Von Hagens, G.; Tiedemann, K. y Kriz, W. (1987). The current potential of plastination. Anat Embryol, 175, 411-421.